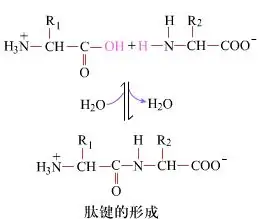
Dina beungeut cai, formasi beungkeut péptida, ngahasilkeun dipéptida, nyaéta prosés kimiawi basajan.Ieu ngandung harti yén dua komponén asam amino disambungkeun ku beungkeut péptida, beungkeut amida, bari keur dehidrasi.
Formasi beungkeut péptida nyaéta aktivasina asam amino dina kaayaan réaksi hampang.(A) gugus karboksil, asam amino kadua (B) Bagian karboksil nu diaktipkeun nukléofilik tuluy ngabentuk dipéptida (AB)."Lamun komponén karboksil (A) teu ditangtayungan, formasi beungkeut péptida teu bisa dikawasa."Produk sampingan sapertos péptida linier sareng siklik tiasa dicampur sareng sanyawa target AB.Ku alatan éta, sakabéh gugus fungsi nu teu kalibet dina formasi beungkeut péptida kudu ditangtayungan ku cara malik samentara salila sintésis péptida.
Janten, sintésis péptida - formasi unggal beungkeut péptida - ngalibatkeun tilu léngkah agrégasi.
Léngkah munggaran nyaéta nyiapkeun sababaraha asam amino anu peryogi panyalindungan, sareng struktur zwitterionic asam amino henteu aya deui.
Léngkah kadua nyaéta réaksi dua-léngkah pikeun ngabentuk beungkeut péptida, dimana gugus karboksil tina asam amino anu ditangtayungan-N mimiti diaktipkeun kana perantara aktip lajeng beungkeut péptida kabentuk.Réaksi gandeng ieu bisa lumangsung boh salaku réaksi hiji-léngkah atawa salaku dua réaksi sequential.
Léngkah katilu nyaéta panyabutan selektif atanapi panyabutan lengkep dasar pelindung.Sanajan sakabéh panyabutan ngan bisa lumangsung sanggeus sakabéh ranté péptida geus dirakit, panyabutan selektif gugus pelindung ogé diperlukeun pikeun neruskeun sintésis péptida.
Kusabab 10 asam amino (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec jeung Cys) ngandung gugus fungsi ranté samping, nu merlukeun panyalindungan selektif, sahingga sintésis péptida leuwih pajeulit.Dasar panyalindungan samentawis sareng semi-permanén kedah dibédakeun kusabab sarat anu béda pikeun selektivitas.Grup panyalindungan samentara dipaké dina lengkah saterusna pikeun ngagambarkeun panyalindungan samentara asam amino atawa gugus fungsi karboksil.Gugus pelindung semi-permanén dipiceun tanpa ngaganggu beungkeut péptida anu parantos kabentuk atanapi ranté samping asam amino, sakapeung salami sintésis.
"Idéalna, aktivasina komponén karboksil sareng formasi salajengna beungkeut péptida (réaksi gandeng) kedah gancang, tanpa formasi rasemik atanapi ku-produk, sareng réaktan molar kedah diterapkeun pikeun ngahontal hasil anu luhur."Hanjakal, taya sahiji metodeu gandeng kimiawi nyugemakeun sarat ieu, sarta sababaraha cocog pikeun sintésis praktis.
Salila sintésis péptida, gugus fungsi nu kalibet dina rupa-rupa réaksi biasana numbu ka puseur manual, glisin jadi hiji-hijina pangecualian, sarta aya resiko poténsi rotasi.
Léngkah ahir dina siklus sintésis péptida nyaéta ngaleungitkeun sadaya gugus pelindung.Ngaleungitkeun selektif gugus pelindung penting pikeun ekstensi ranté péptida salian ti sarat pikeun ngaleungitkeun lengkep panyalindungan dina sintésis dipéptida.Strategi sintétik kedah direncanakeun sacara saksama.Gumantung kana pilihan strategis, N sacara selektif tiasa nyabut gugus pelindung α-amino atanapi karboksil.Istilah "strategi" nujul kana runtuyan réaksi kondensasi asam amino individu.Sacara umum, aya bédana antara sintésis bertahap sareng kondensasi fragmen.Sintésis péptida (ogé katelah "sintésis konvensional") lumangsung dina leyuran.Dina kalolobaan kasus, manjang bertahap tina ranté péptida ngan bisa disintésis ku ngagunakeun ranté péptida pikeun sintésis fragmen pondok.Pikeun nyintésis péptida anu langkung panjang, molekul udagan kedah dibagi kana fragmen anu pas sareng ditangtukeun yén éta tiasa ngaminimalkeun darajat diferensiasi di terminal C.Saatos fragmen individu laun-laun dirakit, sanyawa target bakal dihijikeun.Strategi sintésis péptida ngawengku pilihan fragmén pelindung anu pangsaéna sareng paling pas, sareng strategi sintésis péptida kalebet pilihan kombinasi basa pelindung anu paling pas sareng metode konjugasi fragmén anu pangsaéna.
waktos pos: Jul-19-2023